Большое место в работе учёных РН ЦИР компании «Роснефть» занимают исследования производства эфиров карбоновых кислот, необходимых для производства высококачественных масел и присадок.
Карбоновые кислоты – знакомые незнакомцы
Карбо́новые кисло́ты – это класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми, например, уксусная кислота CH3COOH.
Карбоксильная группа названа так потому, что в её состав входят карбонильная группа С=О и гидроксогруппа -ОН. Но свойства карбоксильной группы не представляют собой простой суммы свойств карбонила и гидроксогруппы. У неё свои особые свойства и функции, поэтому карбоксильную группу называют функциональной.
В зависимости от числа карбоксильных групп -СООН, присутствующих в молекуле кислоты, различают одноосновные (монокарбоновые) кислоты, двухосновные (дикарбоновые) кислоты, многоосновные (поликарбоновые) кислоты.
По систематической номенклатуре (классификации) карбоновые кислоты называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание «овая» и слово «кислота». При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН3-СН2-СООН – пропановая кислота, СН3-С(СН3)2-СООН – 2,2-диметилпропановая кислота.
По рациональной номенклатуре к названию углеводорода добавляют окончание «карбоновая» и слово «кислота», не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С5Н9СООН – циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН – трет-бутилкарбоновая кислота.
Многие из карбоновых кислот имеют тривиальные (или природные) названия.
Например, метановая кислота – это муравьиная. Этановая – уксусная, октадециловая – стеариновая, этандиовая – щавелевая, бутандиовая – янтарная, полигидроксикарбоновая – хинная кислота.
Как видим, многие карбоновые кислоты хорошо знакомы нам. А некоторые из них известны ещё с глубокой древности. Например, уксусная кислота. Получение её при сухой перегонке (нагревании без доступа воздуха) древесины описано в сочинениях Иоанна Глаубера и Роберта Бойля. Однако природа этого вещества не была известна до XIX века. Алхимики считали, что при брожении вина винный спирт превращается в уксус, принимая на себя частицы соли – винного камня (гидротартрат калия). Ещё в XVIII веке брожение объясняли соединением кислых и горючих начал вина. Лишь в 1814 году великий шведский химик Якоб Бёрцелиус определил состав уксусной кислоты, а в 1845 году немецкий химик Адольф Вильгельм Герман Кольбе осуществил её полный синтез из угля.
Муравьиную кислоту впервые получил в 1670 году английский естествоиспытатель Джон Рей, нагревая муравьёв в перегонной колбе.
Муравьиная кислота содержится в выделениях муравьёв, крапиве, пчелином яде, сосновой хвое, уксусная кислота – продукт уксуснокислого брожения. Масляная кислота образуется при прогоркании сливочного масла. Валериановая кислота есть в валериановом корне. Капроновая, каприловая и каприновая кислоты получили своё название из-за того, что содержатся в козьем молоке (латинское слово caper – козёл). Энантовая кислота получила своё название от греческих oine – вино, и anthos – цветок. Пеларгоновая кислота содержится в летучем масле пеларгонии розовой и других растений семейства гераниевых. Лауриновая кислота (также лавровая) имеется в больших количествах в лавровом масле. Миристиновая кислота преобладает в масле растений семейства миристиковых, например в ароматных семенах мускатного дерева – мускатном орехе. Пальмитиновую кислоту легче всего выделить из пальмового масла, выжимаемого из ядер кокосового ореха (копры). Stear по-гречески означает жир, сало – отсюда и название стеариновой кислоты. Вместе с пальмитиновой она относится к наиболее важным жирным кислотам и составляет главную часть большинства растительных и животных жиров. Из смеси этих кислот (стеарина) раньше изготовляли свечи. Арахиновая кислота встречается в масле земляного ореха – арахиса. Бегеновая кислота содержится в бегеновом масле, которое выжимают из крупных, как орех, семян распространённого в Индонезии растения семейства моринговых. Практически чистую лигноцериновую кислоту (латинское слово lignum – дерево, древесина и cera – воск) извлекают из смолы бука. Раньше эту кислоту называли также карнаубовой, потому что её довольно много в карнаубском воске, которым покрыты листья бразильской восковой пальмы. Кислоты с более длинными молекулами встречаются в основном уже в восках, например церотиновая, монтановая (в горном воске (монтан-воске), от лат. montana – гористые места, горные области), мелиссиновая (в пчелином воске, melissa по-гречески – пчела), лацериновая. Разветвлённая фтионовая кислота (3,13,19-триметилтрикозановая) (от греч. phthisis – чахотка) содержится, как и туберкулостеариновая (является левовращающим изомером 10-метилоктадекановой или 10-метилстеариновой), в оболочке туберкулёзной палочки.
Это всё – одноосновные кислоты.
 Все кислоты хороши – выбирай на вкус
Все кислоты хороши – выбирай на вкус
А вот двухосновные кислоты, их достаточно много.
В щавеле, а также в ревене содержится щавелевая кислота. Эта простейшая двухосновная кислота – продукт распада некоторых аминокислот, например глицина. При нарушении обмена веществ (например, при недостатке витамина B6) в организме человека выделяется её малорастворимая кальциевая соль. Янтарная кислота была синтезирована ещё алхимиком Агриколой при прокалывании янтаря. Малоновая кислота получила своё название от лат. malum – яблоко. Фумаровая кислота (от латинского fumus – дым) была обнаружена в растении Fumaria officinalis (дымянка), которое в античные времена сжигали, чтобы дымом отогнать злых духов. Глутаровая кислота (получена из глутаминовой кислоты) получила название от латинского слова gluten – клей, поскольку была найдена в клейковине пшеницы. Брассиловая кислота (НООС–(СН2)11–СООН) найдена в масле растений семейства Brassica (крестоцветных), тапсиевая (НООС–(СН2)14–СООН) – от растения тапсия с греческого острова Тапсос, которое употреблялось в древности как лекарственное, японовая (НООС–(СН2)19–СООН) – выделена из высушенного сока некоторых акаций и пальм, растущих в Юго-Восточной Азии.
Все эти кислоты относятся к числу предельных, то есть не имеющих открытых связей.
Непредельных карбоновых кислот также немало.
Простейшая из них, акриловая, имеет острый запах (на латыни acris – острый, едкий), получается при дегидратации глицерина (при пригорании жиров). Название кротоновой кислоты происходит от растения Croton tiglium, из масла которого она была выделена. Ангеликовая кислота – из ангеликового масла, полученного из ангеликового (дягильного) корня растения Angelica officinalis – дягиля, он же дудник. А тиглиновая – из того же масла Croton tiglium, что и кротоновая кислота, только названа по второй части этого ботанического термина. Сорбиновая кислота была получена из ягод рябины (на латыни – sorbus). Эруковая кислота была выделена из масла растения Eruca – того же семейства Brassica, что и капуста, а также из масла репы (Brassica napus), при длительном нагревании с сернистой кислотой эруковая кислота изомеризуется в брассидиновую.
Самая распространённая из высокомолекулярных непредельных кислот – олеиновая. Изомерна ей элаидиновая кислота. Наибольшей биологической активностью обладают кислоты с несколькими двойными связями: линолевая с двумя, линоленовая с тремя и арахидоновая с четырьмя. Полиненасыщенные кислоты организм человека сам синтезировать не может и должен получать их готовыми с пищей. Названия этих кислот произошли от греч. elaion и лат. oleum – масло, а название арахидоновой (как и арахиновой) происходит от арахиса. Ненасыщенная рицинолевая кислота выделена из касторового масла, которое содержится в семенах клещевины (Ricinus communis). Другая непредельная трёхосновная аконитовая кислота выделена из ядовитых растений Aconitum семейства лютиковых, а название непредельной двухосновной итаконовой кислоты было получено просто перестановкой букв в названии аконитовой кислоты.
Таририновая кислота с ацетиленовой связью была выделена из горького экстракта коры американского тропического дерева рода Tariri antidesma.
Выше мы упомянули об изомерности кислот. Давайте расскажем подробней о химических изомерах. Ведь всё разнообразие химических веществ основано на этом явлении.
Главный закон химии – перестановка мест слагаемых меняет сумму свойств
Изомерия (от др.-греч. σος – «равный», и μέρος – «доля, часть») заключается в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Примером простейших изомеров могут служить винная и виноградная кислоты, после исследования которых Якоб Бёрцелиус в 1830 году ввёл термин «изомерия» и высказал предположение, что различия возникают из-за «различного распределения простых атомов в сложном атоме» (то есть в современных терминах, молекуле).
Подлинное объяснение изомерия получила лишь во 2-й половине XIX века на основе теории химического строения великого русского химика А.М. Бутлерова (структурная изомерия) и стереохимического учения Я.Г. Вант-Гоффа (пространственная изомерия).
В 60-е годы XIX века Александр Бутлеров создал теорию химического строения органических соединений. Сущность этой теории можно изложить так:
1. Атомы, входящие в состав органических веществ, не находятся в беспорядочном движении, а соединены между собой в определённой последовательности химическими связями согласно своей валентности. Последовательность соединения атомов в молекуле Бутлеров назвал химическим строением.
2. От строения молекул, то есть от того, каким образом соединены атомы в молекуле, зависят свойства вещества.
3. Зная свойства вещества, можно установить его строение, и наоборот, химическое строение органического вещества может многое сказать о его свойствах.
4. Химические свойства атомов и атомных группировок не являются постоянными, а зависят от других атомов (атомных групп), находящихся в молекуле. При этом наиболее сильное влияние атомов наблюдается в случае, если они связаны друг с другом непосредственно.
5. Строение молекулы можно выразить при помощи структурной формулы, которая для данного вещества является единственной.
Теория химического строения дала возможность объяснить явление изомерии. Например, одной и той же молекулярной формуле С2Н6О могут соответствовать два различных по строению вещества – этиловый спирт (этанол) и диметиловый эфир:
СН3-СН2-ОН СН3-О-СН3
этанол диметиловый эфир
Следовательно, этанол и диметиловый эфир – изомеры. Они имеют различное химическое строение при одном и том же составе и молекулярной массе. Различное химическое строение и различные свойства этих соединений. Так, этанол при обычных условиях реагирует с металлическим натрием и кислотами, а диметиловый эфир таких реакций не даёт.
В процессе создания теории строения А.М. Бутлеров пришёл к мысли, что органические соединения должны иметь пространственное строение. Это было вызвано прежде всего тем, что некоторые случаи изомерии (геометрическая и оптическая) трудно было объяснить с точки зрения плоскостного строения молекул.
Смелая догадка гениального химика вскоре была подтверждена. В 1874 г. голландский химик Вант Гофф и француз Бель независимо друг от друга высказали идею, согласно которой четыре валентности атома углерода (если представить, что сам углерод находится в центре) направлены в пространстве к четырём углам тетраэдра. Эта идея открыла одну из тайн природы: в качестве основного геометрического элемента для органической химии она избрала тетраэдр. Великий мыслитель древности Платон как будто предвидел, что углеводороды станут основным горючим веществом, своего рода «кровью» индустриальной экономики, когда отнёс тетраэдр к стихии огня.
Таким образом, теория строения А.М. Бутлерова дополнилась теорией о пространственном расположении атомов в молекуле, которая легла в основу новой науки – стереохимии. Значение теории химического строения А.М. Бутлерова исключительно велико. Благодаря этой теории стало возможным предсказать основные свойства органических соединений, предвидеть пути их направленного синтеза. Теория химического строения впервые позволила химикам взглянуть на молекулу как на систему, в которой существует строгий порядок химической связи между атомами.
Сложные эфиры – это очень просто!
Карбоновые кислоты сами по себе находят применение в промышленности, но ещё более востребованы их производные – сложные эфиры.
Сложные эфиры являются производными не только кислот, но и спиртов. Их можно считать продуктом замещения гидроксильного водорода в спирте на радикал кислоты, или как продукт замещения гидроксила в карбоксильной группе кислоты на остаток спирта.
Справка:
Эфиры – совокупное название нескольких классов химических соединений. Эта многозначность сложилась в процессе развития химической номенклатуры (изначально существовал один общий класс веществ).
Простые эфиры – органические соединения, в молекулах которых два углеводородных радикала связаны атомом кислорода.
Сложные эфиры – производные карбоновых или минеральных кислот, в которых гидроксильная группа -OH кислотной функции заменена на спиртовой остаток.
Полиэфиры – высокомолекулярные соединения, получаемые поликонденсацией многоосновных кислот или их альдегидов с многоатомными спиртами.
Эфир (серный эфир) – тривиальное (природное) название диэтилового эфира (в медицине и технике).
Эфирные масла – смесь жидких пахучих летучих веществ, выделенных из растительных материалов (дистилляцией, экстракцией, прессованием).
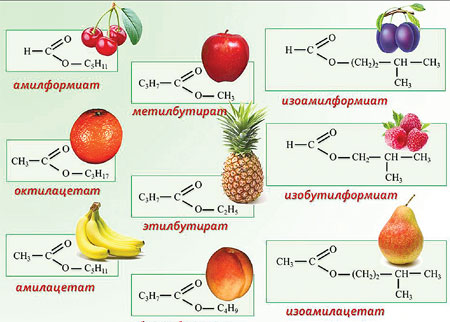
Названия сложных эфиров традиционно создают от наименований образующих их спирта и кислоты. Частенько употребляют также наименования, которые выводят из наименования углеводородного радикала спирта и корня латинского наименования кислоты (либо, что то же, корня наименования радикала данной кислоты) с добавлением к крайнему окончания -ат.
Сложные эфиры могут быть как водянистыми, так и жёсткими веществами в зависимости от молекулярного веса образующих их кислоты и спирта. Сложные эфиры низших и средних гомологов – летучие воды с характерным, частенько приятным запахом. Почти все из них являются носителями аромата разных плодов, овощей и фруктов. Сложные эфиры сложнее растворимы в воде, чем образующие их спирты и кислоты. Так, этиловый спирт и уксусная кислота смешиваются с водой во всех отношениях, тогда как уксусно-этиловый эфир тяжело растворим в воде. В органических растворителях сложные эфиры растворяются отлично.
В случае эфиров карбоновых кислот выделяются два класса сложных эфиров:
– собственно сложные эфиры карбоновых кислот общей формулы R1–COO–R2, где R1 и R2 – углеводородные радикалы.
– ортоэфиры карбоновых кислот общей формулы R1–C(OR2)3, где R1 и R2 – углеводородные радикалы.
В конце XIX – начале XX века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
Сложные эфиры широко используются в качестве растворителей, пластификаторов, ароматизаторов. Область их применения расширяется с каждым годом.
Учёные РН-ЦИР компании «Роснефть» ведут исследования процессов производства эфиров высших непредельных карбоновых кислот по реакции сометатезиса акрилатов с терминальными олефинами.

